
Un médicament est conçu pour être biologiquement actif. Et si la priorité est de rechercher le bénéfice thérapeutique, l’attention se porte de plus en plus sur les risques écotoxicologiques et sanitaires que de telles substances chimiques peuvent présenter. En effet, jusqu’à une période récente, ce sont essentiellement les rejets dans l’environnement aquatique des composés d’origine agricole et industrielle qui ont fait l’objet d’études scientifiques et de réglementations draconiennes.
Les médicaments sont consommés de façon quotidienne et dans certains pays industrialisés, la prise annuelle dépasse le millier de tonnes. En Europe, 3 000 principes actifs sont utilisés par la médecine.
Et si pour les antibiotiques une diminution de la consommation européenne de 5,7 % a été observée au cours des hivers 2011/2012 et 2013/2014, il n’en est pas de même pour tous les médicaments, en particulier en milieu hospitalier. Les anticancéreux figurent parmi les composés dont l’utilisation est en constante augmentation. Partiellement éliminés dans le corps humain, ils sont excrétés transformés ou inchangés, le plus souvent conjugués à des molécules polaires, par les urines et les selles dans les eaux d’égouts. Leurs métabolites présentent souvent un potentiel toxique beaucoup plus élevé que la molécule mère. Par ailleurs, lorsque le composé est lié à d’autres substances chimiques, cette conjugaison peut être facilement cassée lors du traitement en station d’épuration et les résidus pharmaceutiques originaux sont rejetés, la plupart du temps dans les influents d’usines de traitement où ils ne sont pas complètement éliminés ou dégradés.
Une étude réalisée dans 12 pays a montré une contamination de l’environnement aquatique par plus de 80 composés englobant la plupart des familles de substances médicamenteuses et leurs métabolites (1). La France fait partie de la longue liste des pays européens où la présence de composés tels que la carbamazepine, l’acide clofibrique et le diclofenac dans les effluents de station d’épuration a été confirmée (2).
Une soupe de polluants à l’état de traces
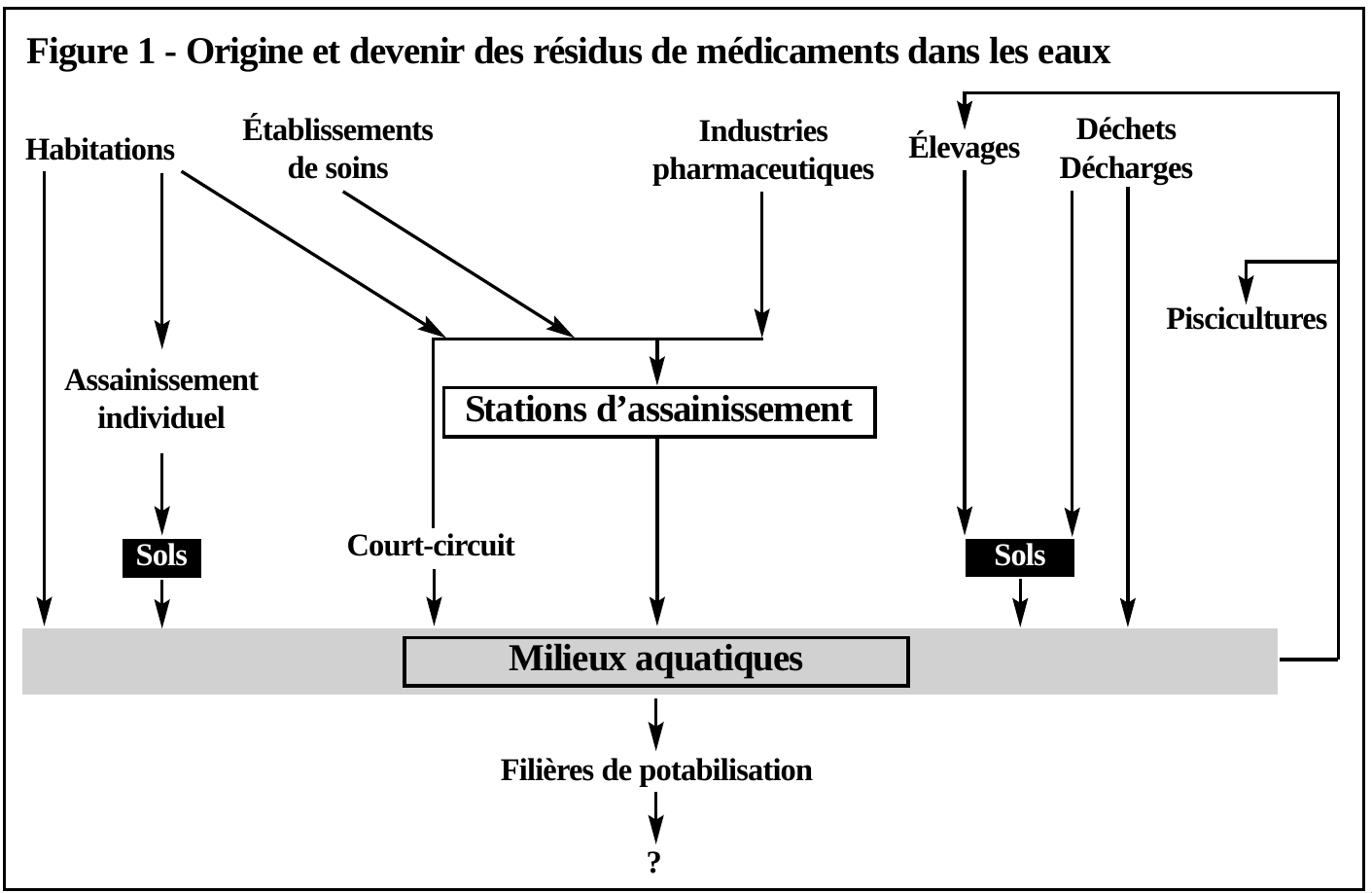
Cette introduction dans l’environnement aquatique se fait en continu (figure 1). Les concentrations sont faibles, situées dans une échelle de quelques ng/L à quelques mg/L, mais l’hydrophobicité élevée des principes actifs engendre souvent une persistance prolongée dans les milieux hydriques. À cela s’ajoute la possibilité d’interactions lors des mélanges de molécules de mode d’action semblable, mais aussi très différents. Un suivi aux États-Unis a permis de détecter un agent antibactérien, la lincomycine, en combinaison avec 27 autres produits chimiques (3). L’évaluation des risques doit donc porter sur les effets toxiques de produits chimiques se trouvant à l’état de traces au sein de mélanges complexes de polluants dans les effluents de stations d’épuration, mais aussi dans les eaux superficielles et souterraines. Toute la chaîne de la problématique doit être prise en compte, sans oublier les étapes de potabilisation. Dans ce domaine, les données manquent et c’est seulement dans peu de cas que des résidus pharmaceutiques ont été détectés dans l’eau potable. Il apparaît cependant qu’une contamination existe dans plusieurs pays employant pourtant des systèmes sophistiqués de traitement de l’eau. À titre d’exemple, la présence d’un hypolipémiant, l’acide clofibrique, a été confirmée dans 14 échantillons d’eau potable de la ville de Berlin à des concentrations maximales de 270 ng/L (4). Des anti-inflammatoires non stéroïdiens, la phénazone et la propylphénazone ont également été détectés dans les eaux de cette ville à des concentrations équivalentes lors de deux études séparées (5 et 6).
Les médicaments entrent ainsi dans une préoccupation globale de l’effet écotoxique, en ce qui concerne l’eau en tant que milieu, et de l’effet sanitaire pour l’eau comme ressource, de mélanges complexes de polluants englobant les plastifiants, les pesticides, les hydrocarbures, les solvants et les cosmétiques.
Alors que toutes les actions se conjuguent, les caractéristiques de l’environnement jouent, elles aussi, sur la distribution de la contamination. Il a été montré qu’un antiparasitaire tel que l’ivermectine se dégrade beaucoup plus rapidement sur des terrains sableux que sur des sols argileux et la demie vie de ce composé est six fois plus longue en hiver comparativement à l’été (7). Les estuaires sont de véritables pièges à polluants et représentent des réservoirs de contaminants dans lesquels il est extrêmement complexe de différencier les effets de telles ou telles molécules. Et lorsque les substances chimiques arrivent en milieu marin, certaines se dégradent, d’autres non. De plus, si la contamination est essentiellement en phase dissoute, on ne peut négliger celle qui se fait en phase particulaire.
L’usage vétérinaire, une contribution similaire et différente
En pratique, il n’existe pas de principe actif à usage strictement vétérinaire. Ils proviennent à la fois de la pharmacopée humaine et du domaine phytosanitaire. Les composés se limitent toutefois aux antiparasitaires, aux anti-infectieux qui regroupent les antibiotiques et les antifongiques et aux vaccins.
Pour les substances chimiques à visée thérapeutique humaine, les hôpitaux, les zones urbaines et leurs systèmes d’évacuation des eaux usées constituent la source principale de résidus de médicaments dans l’eau. Ce rôle est tenu par les élevages de production intensive lorsque l’on considère les molécules à usage vétérinaire. En aquaculture, le médicament est directement introduit dans le milieu aquatique. En élevage porcin, ovin, bovin ou aviaire, les résidus arrivent indirectement dans l’eau via l’épandage ou l’excrétion des animaux. Seule la médecine des animaux de compagnie pose une problématique similaire à la médecine humaine. La contamination issue des animaux de rente se rapproche de la pollution liée aux pesticides.
Les antibiotiques, une préoccupation majeure
Au regard de la forte consommation d’antibiotiques dans le monde, que ce soit pour un usage humain ou vétérinaire, il est inévitable de retrouver leurs résidus dans l’environnement hydrique. Mais ce fait n’est pas nouveau, ce sont les progrès analytiques de ces dernières années qui ont permis non seulement la détection de composés présents sous forme de traces à des concentrations de l’ordre du nanogramme par litre, mais aussi une évaluation des risques liés à la présence de bactéries antibiorésistantes dans les différents compartiments aquatiques. En effet, les antibiotiques peuvent induire des effets sur les biomasses bactériennes par l’acquisition de compétences de résistance portées par des fragments de matériel génétique. Dans les pays industrialisés, une corrélation positive existe entre la quantité d’antibiotiques utilisés par habitant et le pourcentage de souches de Streptococcus pneumoniae résistantes à la pénicilline et aux macrolides (8). L’occurrence de souches biorésistantes a été mise à jour dans différents pays, que ce soit dans les eaux d’élevage, dans les rivières et jusqu’à l’eau de mer qui n’est pas épargnée. Il reste une observation qui ne répond à aucune logique. En Inde, des coliformes résistants à divers antibiotiques ont été trouvés dans les eaux d’un fleuve échantillonné sur 250 km entre 300 et 5 000 mètres d’altitude (9).
Une contamination significative par les radiopharmaceutiques
Le suivi de la radioactivité dans différentes stations d’épuration françaises, par prélèvements moyens sur 24 heures ou à l’aide de sondes de mesures en continu via le réseau Téléhydro (IRSN), a abouti à la détection de manière significative et régulière de deux radionucléides artificiels utilisés en médecine, l’iode I131 et le technétium métastable Tc99m. Les quantités décelées peuvent dépasser 10 Bq/L pour I131 et 75 Bq/L pour Tc99m , mais restent en dessous des taux fixés par la réglementation. En revanche, en sortie d’émissaires d’établissements hospitaliers, les niveaux de l’iode I131 dépassent la valeur guide préconisée de 100 Bq/L.
Deux composés largement utilisés en médecine nucléaire, l’iodure de sodium et un analogue de la noradrénaline, la m-iodobenzylguanidine ont été marqués avec I131 . Inoculés à des truites arc-en-ciel, NaI131 s’est retrouvé au niveau des follicules thyroïdiens dans la mâchoire inférieure du poisson avec une activité relative de 94 %, 21 jours après l’injection, alors que le MIBG(I131) était essentiellement localisé dans le foie et la vésicule biliaire avec 30 % de l’activité totale au bout de 21 jours. Il est à noter que les concentrations étaient négligeables dans les muscles.
Des outils analytiques de plus en plus performants
Les problématiques liées au devenir des substances médicamenteuses dans l’environnement aquatique essayent de répondre aujourd’hui à des inquiétudes légitimes. Le niveau de connaissance s’est nettement amélioré ces dernières années et ceci grâce au développement d’outils analytiques qui permettent de révéler l’existence de contaminants à l’état de trace. Les modèles biologiques incluant à la fois des invertébrés tels que l’hydre ou la daphnie, des vertébrés comme la truite ou le poisson zèbre, mais aussi des lignées cellulaires déjà utilisées dans d’autres domaines environnementaux apportent des ébauches de réponses sur les effets potentiels de cette pollution sur des organismes non cibles.
- (1) Heberer T. « Occurrence, fate, and removal of pharmaceutical residues in the aquatic environment : a review of recent research data » Toxicol. Lett. 2002 May 10 ; 131 (1-2) : 5-17.
- (2) Ferrari B., Paxeus N., Lo Giudice R., Pollio A., Garric J. « Ecotoxicological impact of pharmaceuticals found in treated wastewaters : study of carbamazepine, clofibric acid, and diclofenac » Ecotoxicol. Environ. Saf. 2003 Jul. ; 55 (3) : 359-370.
- (3) Kolpin D.W., Furlong E.T., Meyer M.T., Thurman E.M., Zaugg S.D., Barber L.B., Buxton H.T. « Pharmaceuticals, hormones, and other organic wastewater contaminants in U.S. streams, reconnaissance Technol. 2002 1999-2000 Mar. » Environ. 15 : a ; national 36 (6) Sci. : 1202-1211.
- (4) Dubey J.K., Heberer T., Stan H.J. « Determination of ethylenethiourea in food commodities by a two-step derivatization method and gas chromatography with electron-capture and nitrogen-phosphorus detection » J. Chromatogr. A. 1997 Mar. 21 ; 765 (1) : 31-38.
- (5) Reddersen K., Heberer T., Dunnbier U. « Identification and significance of phenazone drugs and their metabolites in ground- and drinking water » Chemosphere. 2002 Nov. ; 49 (6) : 539- 544.
- (6) Zuhlke S., Dunnbier U., Heberer T. « Detection and identification of phenazone-type drugs and their microbial metabolites in ground and drinking water applying solid-phase extraction and gas chromatography with mass spectrometric detection » J. Chromatogr. A. 2004 Oct. 1 ; 1050 (2) : 201-209.
- (7) Halley B.A., VandenHeuvel W.J., Wislocki P.G. « Environmental effects of the usage of avermectins in livestock » Vet. Parasitol. 1993 Jun. ; 48 (1-4) : 109- 125.
- (8) Albrich W.C., Monnet D.L., Harbarth S. « Antibiotic selection pressure and resistance in Streptococcus pneumoniae and Streptococcus pyogenes » Emerg. Infect. Dis. 2004 Mar. ; 10 (3) : 514-517.
- (9) Baghel V.S., Singh J., Gopal K. « Antimicrobial resistance among enteric bacteria, isolated from runoff of the Gangotri glacier, western Himalaya India » J. Environ. Biol. 2003 Jul. ; 24 (3) : 349-356.
Source: Hélène Petit, cibac mag
